我室杨黄浩教授和宋继彬教授在Angew上发表研究论文“Promoted Tumor Penetration and Sono‐Chemodynamic Therapy of Orthotopic Liver Cancer”
超声(US)是一种无创、深穿透的机械波,在生物医学领域具有广泛的应用。声动力疗法(SDT)是一种基于US的治疗方式,通过活性氧(ROS)的产生和声敏剂的声空化作用,在超声刺激下杀死癌细胞。由于Au NPs的粗糙表面可作为成核位点并降低空化阈值,并克服了常规有机声敏剂的稳定性低、水溶性差的限制,因此可将其作为声敏剂。此外,由于增强的热和机械效应,使用Au NPs作为声敏剂通过空化产生ROS不仅可以产生单线态氧(1O2),而且可以产生羟基自由基(·OH),使其适用于缺氧肿瘤的治疗。然而,目前用于SDT的纳米平台由于其大尺寸而不能充分发挥US的优势,敏感性低,治疗效果有限。此外,肿瘤的异常血管和致密细胞外基质限制了声敏剂的组织穿透,进一步限制了SDT的疗效。氧化锰纳米颗粒(MnO NPs)可以分解释放Mn2+用于响应谷胱甘肽(GSH)的类Fenton反应。已有报道称US激波的局部湍流可提高Fenton反应的效率。因此,具有双相核心几何结构的Janus纳米颗粒(JNPs)可提供在一个NP中结合两种不同功能的能力。此外,JNPs相对较小的尺寸可显著提高其组织穿透性。
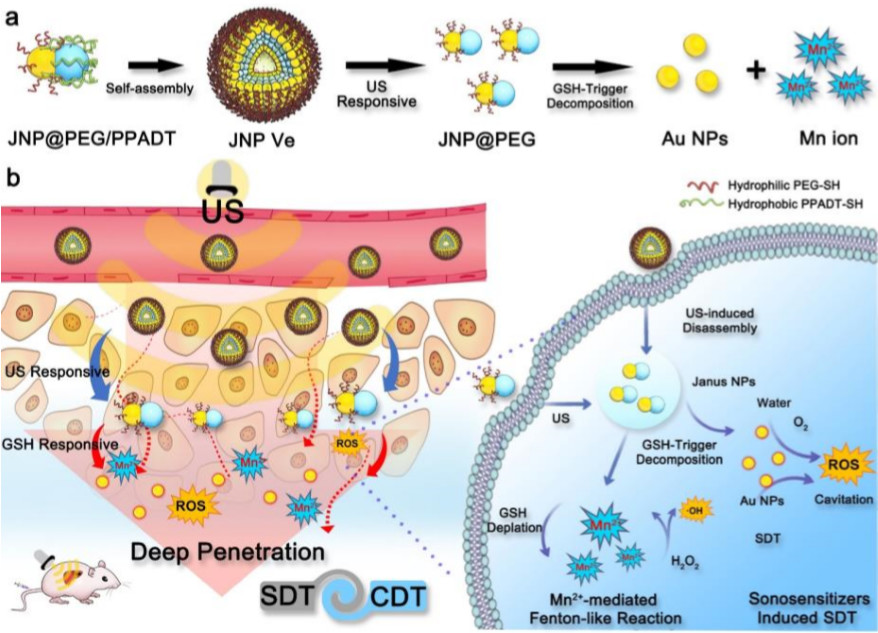
有鉴于此,我室杨黄浩教授和宋继斌教授研究团队通过两亲性Janus Au-MnO NPs的自组装,开发出新型的US和GSH双响应纳米囊泡,可将其作为一种高效的声敏剂。此囊泡可表现出针对特定肿瘤成像的肿瘤激活的NIT-II PAI和T1-MRI信号。在US和GSH刺激下,囊泡首先分解成小的AuMnO NPs以增强肿瘤的穿透,然后进一步分解成更小的Au NPs和Mn2+,分别用于增强SDT和引发CDT。这种新型声敏纳米囊泡可增加原位肝肿瘤中的纳米药物渗透,并通过增强的T1-MRI和PAI,协同SDT和CDT抑制肿瘤生长。这种JNP Ves有望成为成像引导的深部肿瘤精准治疗药物。
论文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.201912768